今天為大家介紹俄亥俄州立大學的 Li Jianrong 團隊和芝加哥大學何川團隊在 2019、2020 年相繼發表的兩篇文章,文章研究思路基本一致,都是針對病毒 RNA 上 m6A 修飾機對病毒生命周期的影響和對病毒逃避宿主免疫應答的研究,同時發現 m6A 缺陷型病毒株的毒力減弱,但免疫原性依然不變,可作為未來疫苗研制的候選。接下來就讓我們一起梳理下研究思路,以 2020 年 發表的文獻為例。

背景:
人類偏肺病毒(HMPV) 是副黏液病毒科下的一種單鏈核糖核酸病毒,于 2001 年在荷蘭被首度發現。病毒主要令兒童受急性呼吸道感染,病征包括發燒、咳嗽、氣促及呼吸困難等。抵抗力弱的成年人也有機會受感染。
先天性免疫系統保證了人類面對病毒感染能快速做出反應,并且正確區分自身核酸與非自身核酸,并對非自身核酸及時發生免疫反應。病毒 RNA 在細胞質中復制,會涉及到 RIG- I 和 MDA5。宿主一旦識別到病毒,細胞內信號立即被激活,刺激了Ⅰ型干擾素和許多炎癥因子、細胞因子的表達,以建立一個抗病毒的狀態。IFN- α 和 IFN- β 是先天性免疫反應的特征分子標志物,被感染的細胞分泌,以限制病毒的復制、擴散和適應免疫調節。
RNA 轉錄后修飾對于宿主細胞區分自身和非自身核酸是非常重要的分子標記。通常自身 mRNA 在 5' 端有帽子結構,同時在鳥嘌呤(G)N7 和 ribose-2′- O 位置發生甲基化,就不會被 RIG- I 和 MDA5 識別發現。 然而,當 mRNA 缺失該結構(甲基化),免疫系統就會識別到非自身的 RNA。病毒很聰明,為了避免被干掉,進化出 RNA 甲基化修飾,以避免被免疫系統發現干掉。
摘要:
作者使用人類偏肺病毒(HMPV)作為模型,證明 m6A 修飾可作為病毒 RNA 上的分子標記物來躲避宿主對非自身 RNA 的先天性免疫識別。HMPV RNA m6A 修飾促進了 HMPV 的復制和基因表達。通過同義突變或去甲基化酶構建 m6A 缺陷型重組 HMPV 病毒(m6A-deficient rHMPV),發現誘導了宿主Ⅰ型干擾素的分泌增加,并發現這取決于細胞質中的傳感器 RIG-I。m6A-deficient rHMPV 在棉鼠體內實驗表明干擾素分泌增加,毒性減弱,但保留了高免疫原性。
總結兩點發現:
1. 作者發現病毒模仿宿主細胞 mRNA 上的甲基化修飾,以躲避免先天性免疫的檢測;
2. m6A 修飾可以作為減毒 HMPV 的靶標,用于疫苗研發。
研究結果:
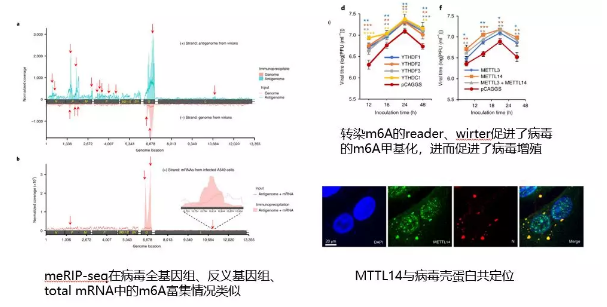
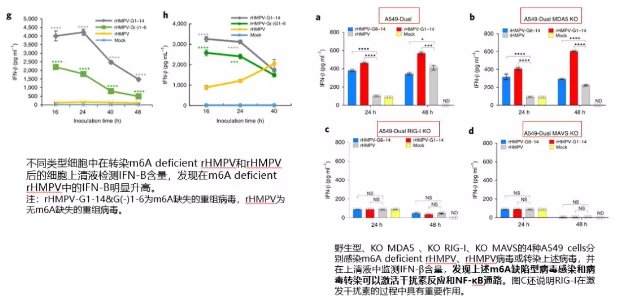
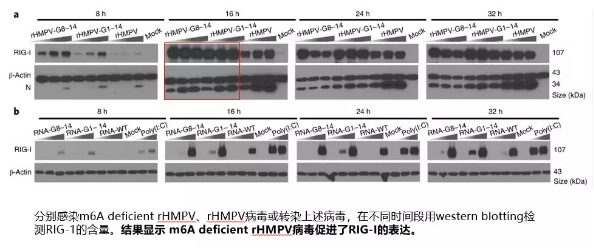
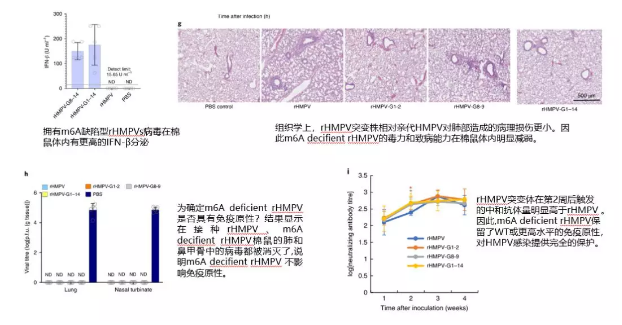
作者對病毒 RNA 基因組上 m6A 修飾對病毒感染能力和與宿主互作過程進行探索。通過構建 rHMPV、m6A-deficient rHMPV 病毒和病毒 RNA 分別感染和轉染宿主細胞來探索宿主免疫應答過程中起關鍵作用的介質。 文中病毒基因組 m6A 檢測方法不同于 上篇軟文 病毒 RNA m6A 的檢測方法,上篇是提取病毒感染宿主后的 total RNA,再分別和各自的參考基因組比對。這里作者是使用了超微量 MeRIP-seq 試劑盒(只需 1 -5ug),直接對病毒 RNA 建庫測序,再比對分析。
其實在 2019 年何川和 Li Jianrong 就發表了文章“m6A 修飾促進了人類呼吸道合胞病毒(RSV)的復制和致病能力”,研究思路與上篇基本一致,但研究對象換了另一種病毒 RSV。

背景:
人類呼吸道合胞病毒(RSV)是肺炎科病毒的成員之一。RSV 是嬰兒,幼兒和免疫功能低下者上呼吸道和下呼吸道感染的重要原因,并且僅次于老年人的流感病毒。 據估計,在全球范圍內,RSV 導致 5 歲以下兒童中的 340 萬人住院,并有 66,000 至 199,000 人死亡。盡管付出了巨大的努力,但尚無用于 RSV 的疫苗或抗病毒藥物。
摘要:
文章發現 RSV 基因組上發生了 m6A 甲基化,這些位點可正向調節 HeLa 和 A549 細胞中 RSV 的復制,基因表達和病毒產生。通過對 m6A 位點進行點突變構建 m6A 缺陷型 rgRSV,發現 rgRSV 在 A549 細胞的復制,基因表達,擴散和病毒成熟等方面都明顯減少。棉鼠體內實驗顯示 m6A 突變型 rgRSV 感染棉鼠后,上呼吸道和下呼吸道中病毒復制減少,且肺部病變較輕。同時發現 m6A 突變型 rgRSV 在棉鼠體內實現顯示毒力減弱明顯,但仍保留了野生型毒株的免疫原水平,說明 m6A 修飾缺陷型的病毒可用于為未來疫苗研制候選。
至此 RNA m6A 修飾在病毒和病毒感染中的研究方案已結束,希望可以為各位老師的研究提供一點靈感和素材。
咨詢在線客服。
上篇回顧:《m6A 修飾在病毒和病毒感染中的研究方案(上)》


