2 月 11 日,世界衛(wèi)生組織(WHO)正式將新冠肺炎病命名為 COVID-19,國(guó)際病毒分類委員會(huì)(ICTV)將新冠病毒命名為 SARS-CoV-2。SARS-CoV 病毒引起 SARS 病,SARS-CoV- 2 病毒引起 COVID-19 病,從官名上能看出新冠病毒與非典病毒有著密切聯(lián)系,科研人員也揭示了不同病毒間蛋白質(zhì)(氨基酸序列)的差異可能是新冠病毒比 SARS 和 MERS 更具傳染性的原因。除了蛋白方面的差異,病毒基因組也必然存在著差異。從 2003 年的 SARS 到 2012 的 MERS,再到 2020 的 COVID-19,毫無(wú)疑問(wèn),我們?nèi)庋劭床坏降墓跔畈《疽苍诎l(fā)生著變異與進(jìn)化,這些變異有利于病毒自身,卻危害人類生命健康。今天小編要分享的便由變異所起——拷貝數(shù)變異的相關(guān)信息,提供拷貝數(shù)變異檢測(cè)方面的參考。
拷貝數(shù)變異的形成和致病機(jī)制
拷貝數(shù)變異屬于結(jié)構(gòu)變異的一種,可分為拷貝數(shù)增加和拷貝數(shù)減少。拷貝數(shù)變異是人類遺傳多樣性的來(lái)源之一。而且通過(guò)重組、復(fù)制或其他方式產(chǎn)生的拷貝數(shù)變異似乎比單核苷酸多態(tài)性要高得多。但拷貝數(shù)變異并不一定會(huì)導(dǎo)致疾病,可能僅僅是作為一種多態(tài)性而存在,這與大量的單核苷酸多態(tài)性一樣,是良性的。異常的拷貝數(shù)變異通常是癌癥、遺傳病甚至是某些復(fù)雜疾病的重要分子機(jī)制。
拷貝數(shù)變異的產(chǎn)生主要涉及 4 種機(jī)制:
非同源重組、非同源連接、L1 反轉(zhuǎn)錄以及復(fù)制叉滯后連接等。
拷貝數(shù)變異對(duì)表型的影響機(jī)制主要有:
1)基因劑量;
2)功能失活;
3)基因融合;
4)位置效應(yīng);
5)橫向效應(yīng)等。
拷貝數(shù)變異與三體綜合征
人類很早就認(rèn)識(shí)到拷貝數(shù)變異與疾病之間的關(guān)系,但受到檢測(cè)精度的限制,早期的發(fā)現(xiàn)以大的染色體水平的變異為主。隨著基因芯片、高通量測(cè)序等多種檢測(cè)技術(shù)的快速發(fā)展,越來(lái)越多的拷貝數(shù)變異被檢測(cè)出來(lái),包括亞顯微結(jié)構(gòu)的拷貝數(shù)變異檢測(cè)成為可能。
三體綜合征是典型的基因組拷貝數(shù)變異引起的疾病,例如 21 三體綜合征、18 三體綜合征和 13 三體綜合征。21 三體綜合征又名唐氏綜合征,發(fā)病率約為 1 /700。13 三體綜合征于 1657 年被 Thomas Bartholin 初次記載,并由 Klaus Patau 在 1960 年報(bào)道染色體核型,也稱為 Patau 綜合征。18 三體綜合征于 1960 年被 John Hilton Edwards 報(bào)道,也被稱為 Edwards 綜合征。
拷貝數(shù)變異數(shù)據(jù)庫(kù)
拷貝數(shù)變異數(shù)據(jù)收錄于 DGV 數(shù)據(jù)庫(kù)(http://dgv.tcag.ca/dgv/app/home),記錄了一系列基因變異與表型相關(guān)的信息,數(shù)據(jù)庫(kù)信息持續(xù)更新,截至 2020.2.19,DGV 數(shù)據(jù)庫(kù)收錄了總共 72 項(xiàng)研究 6359956 個(gè)樣本的 CNV 信息,大多數(shù)的 CNV 分布在 1 -10Kb,其次為 100-500bp。
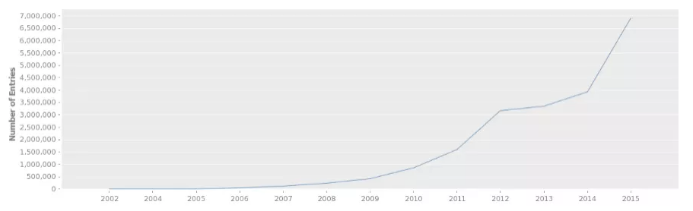
圖 1 DGV 數(shù)據(jù)庫(kù)變異數(shù)目逐年增加情況

圖 2 DGV 數(shù)據(jù)庫(kù) CNV 大小的分布情況
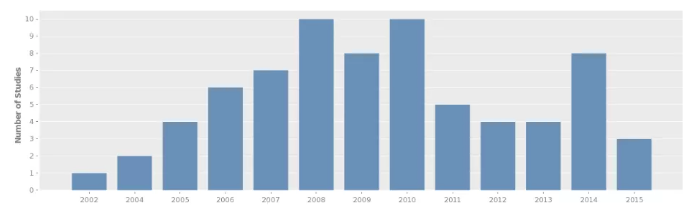
圖 3 DGV 數(shù)據(jù)庫(kù)項(xiàng)目數(shù)情況
拷貝數(shù)變異檢測(cè)平臺(tái)的技術(shù)比較
傳統(tǒng)的染色體核型分析、全基因組范圍內(nèi) CNV 芯片、高通量測(cè)序技術(shù)均可以對(duì) CNV 進(jìn)行檢測(cè),接下來(lái)的兩篇文獻(xiàn)均是關(guān)于芯片和測(cè)序兩大 CNV 檢測(cè)平臺(tái)的比較研究,孰優(yōu)孰劣讓我們一探究竟。
文獻(xiàn) 1 是 2016 年香港中文大學(xué)醫(yī)學(xué)院團(tuán)隊(duì)發(fā)表于國(guó)際醫(yī)學(xué)遺傳學(xué)權(quán)威學(xué)術(shù)雜志 Genetics in Medicine 的文章討論了 NGS 技術(shù)是否可以作為常規(guī)臨床應(yīng)用中 CNV 檢測(cè)的替代方法。

該團(tuán)隊(duì)使用低覆蓋度的全基因組測(cè)序流程,對(duì) 570 名患者的多中心組進(jìn)行了全基因組 CNV 分析(> 50 kb)和芯片檢測(cè)分析。根據(jù)美國(guó)醫(yī)學(xué)遺傳學(xué)和基因組學(xué)指南對(duì) CNV(即致病性 CNV,pCNV)進(jìn)行了分類。結(jié)果發(fā)現(xiàn),CMA 和基于 NGS 的方法在 71 個(gè)驗(yàn)證樣本中的 pCNV 的結(jié)果一致(如下圖表)。
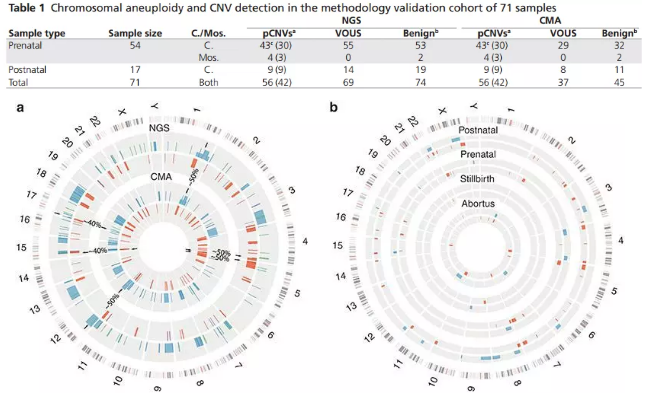
研究者也指出,高深度全基因組測(cè)序(whole genome sequencing,WGS)可以提供整個(gè)基因組的全面視圖,是一種高通量的檢測(cè)單核苷酸變異、插入 / 缺失、拷貝數(shù)變異和基因組結(jié)構(gòu)重組的技術(shù)手段。但目前而言,高深度 WGS 的價(jià)格高昂,且變異信息較多,較難在產(chǎn)前診斷中廣泛應(yīng)用;而基于低深度 WGS 的水平,能夠在降低每個(gè)樣本的測(cè)序成本基礎(chǔ)上,同時(shí)提高檢測(cè)通量,達(dá)到低深度高通量的目的(low-pass WGS)。
文獻(xiàn) 2 也是來(lái)自于同一團(tuán)隊(duì),2019 年 12 月份發(fā)表于 Genetics in Medicine,增加了樣本例數(shù),對(duì)低深度高通量全基因組測(cè)序和染色體微陣列分析進(jìn)行了深入比較,分析結(jié)果支持了將低深度全基因組測(cè)序用于產(chǎn)前診斷中以提供更多有意義的臨床信息。

研究人員將 2016-2019 年入組的 1023 名孕婦同時(shí)進(jìn)行了 CMA 和 NGS 檢測(cè)。CMA 檢測(cè)出共 121 例樣本的異常,包括 87 個(gè)非整倍性和 37 個(gè)致病或可能致病的 CNV,這兩種染色體異常存在部分重疊;而低深度測(cè)序不僅檢測(cè)到了全部的 CMA 檢出的染色體異常,還額外檢測(cè)到 17 例非整倍性或致病 / 可能致病的染色體拷貝數(shù)變異。作者進(jìn)一步分析了測(cè)序分析結(jié)果的靈敏度和特異性,以芯片分析為基準(zhǔn),低深度全基因組測(cè)序達(dá)到了 99.9%(121/121)的靈敏度和 87.7%(121/138)的特異性,總體診斷陽(yáng)性率為 13.5%(138/1023)。在 DNA 起始量方面,芯片起始量 300ng DNA 和低深度測(cè)序起始量 50ng 為標(biāo)準(zhǔn)進(jìn)行了樣本制備,結(jié)果是低深度全基因組測(cè)序樣本中有 5 例未能通過(guò)初期試驗(yàn),而芯片則有 47 例未通過(guò),也就是造成了重復(fù)實(shí)驗(yàn)率分別為 0.5%(5/1023)和 4.6%(47/1023),這些結(jié)果綜合說(shuō)明低深度全基因組測(cè)序應(yīng)用于產(chǎn)前診斷的樣本要求更低,實(shí)驗(yàn)也更加穩(wěn)定。
從 CNV 檢測(cè)技術(shù)總體來(lái)看,傳統(tǒng)的染色體核型分析一直被認(rèn)為是確診染色體變異的標(biāo)準(zhǔn),也是染色體病產(chǎn)前診斷的一線方法,但是檢測(cè)周期長(zhǎng)、分辨率較低,無(wú)法檢出 5Mb 以下的 CNV。目前主要用于全基因組范圍內(nèi) CNV 檢測(cè)的“金標(biāo)準(zhǔn)”技術(shù)為 CNV 芯片,檢測(cè)范圍廣、分辨率較高;缺點(diǎn)是成本較高,在大規(guī)模的產(chǎn)前診斷應(yīng)用中有所限制。而近年來(lái)發(fā)展起來(lái)的高通量測(cè)序技術(shù),為 CNV 檢測(cè)提供了新的手段,具有成本低、通量高、檢測(cè)便捷等優(yōu)勢(shì)。
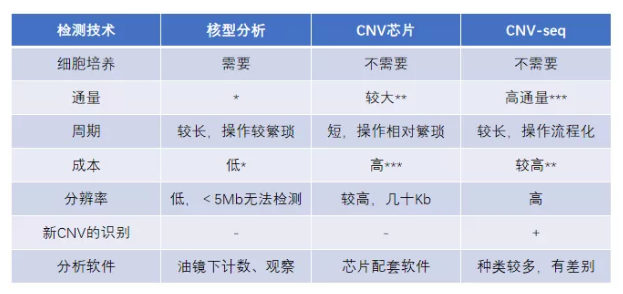
不可否認(rèn),芯片方法依然是拷貝數(shù)檢測(cè)的金標(biāo)準(zhǔn),基于高通量測(cè)序平臺(tái)檢測(cè) CNV 的多篇文獻(xiàn)中也提到了這一點(diǎn),并以此為基準(zhǔn)分析測(cè)序方法的準(zhǔn)確度和靈敏度。高通量的方法作為后起之秀,檢測(cè)結(jié)果依賴于測(cè)序質(zhì)量、測(cè)序數(shù)據(jù)量、分析軟件等,完全替代芯片還需些時(shí)間。伯豪生物提供芯片和高通量測(cè)量測(cè)序兩種平臺(tái)的檢測(cè)服務(wù),小編建議各位老師們可以按需選擇。
這次疫情已導(dǎo)致 7 萬(wàn)余人受到新冠病毒的感染,同時(shí)得到了國(guó)內(nèi)外千千萬(wàn)萬(wàn)人的高度關(guān)注,我們有理由相信,人類終將贏得這場(chǎng)戰(zhàn)“疫”,而勝利之后的人類該會(huì)敬畏自然,善待自然界的其他動(dòng)物們!


