通過功能性磁共振成像生成的整個大腦的多色圖像(經過處理)。
圖片來源:美國國立衛生研究院,國家精神衛生研究所(侵刪)。
自 1906 年初次發現阿爾茨海默病(AD)以來,我們對它的科學認識已經有了很大的進步。然而在預測每個人的疾病如何進展時,目前仍存在很大的不確定性。例如,我們不知道為什么有些人在確診后可以存活 20 年,而事實上確診后的平均存活年限只有 4 到 8 年(1)。2020 年初,兩項針對 β - 淀粉樣蛋白(Aβ,阿爾茨海默病的主要臨床表現為 Aβ 蛋白的積累(2))的臨床試驗均遭遇失敗——使得我們在對這種疾病認知上的空白逐漸浮出水面。這些失敗,加上此前許多候選藥物無法減輕認知能力下降的挫折,一些研究人員重新回到實驗室——他們希望更好地了解與 AD 進展相關的細胞類型,并鑒定新的藥物靶點(3)。
追蹤 AD 進展過程中星形膠質細胞的基因表達變化
據報道,非神經元細胞在阿爾茨海默病的發作和進展中起一定作用。然而,具體機制仍不清楚,部分原因在于這些細胞的異質性讓傳統的大量細胞分析充滿挑戰(4,5)。認識到這一基本問題后,來自耶路撒冷希伯來大學、魏茲曼研究所、Broad 研究所和麻省理工學院的研究人員聯合構建了詳細的海馬體細胞分子圖譜,以鑒定這一腦區的非神經元細胞群在 AD 中扮演的角色(5)。
為了構建這些圖譜,研究人員采用 Chromium 單細胞基因表達技術,對野生型小鼠或轉基因 AD 小鼠模型海馬體中的 54,769 個單細胞核開展 RNA-seq 分析。他們的比較分析表明,星形膠質細胞可分為三種主要的轉錄狀態,其中一種是 AD 模型所特有的。時間點分析表明,AD 特異性的亞群,又稱為疾病相關的星形膠質細胞(DAA),出現在認知能力下降之前,而且各個時間點的發生率逐漸增加,反映出更晚期的疾病狀態。此外,這個亞群位于疾病表現較嚴重的大腦區域中 Aβ 斑塊的附近。
盡管動物模型為了解疾病機制提供了一個很好的窗口,但從這些模型中獲得的結論并不一定能夠轉化到人類疾病。這項研究從這些結果與人類的相關性中排除了猜測,發現了衰老的死后大腦中三種不同轉錄狀態的等效物以及 AD 患者中較高頻率的 DAA 樣細胞。這些結果表明了星形膠質細胞在阿爾茨海默病(特別是 zuì 初的發病機制)中的動態激活過程,并暗示 DAA 有望成為新的治療靶點。
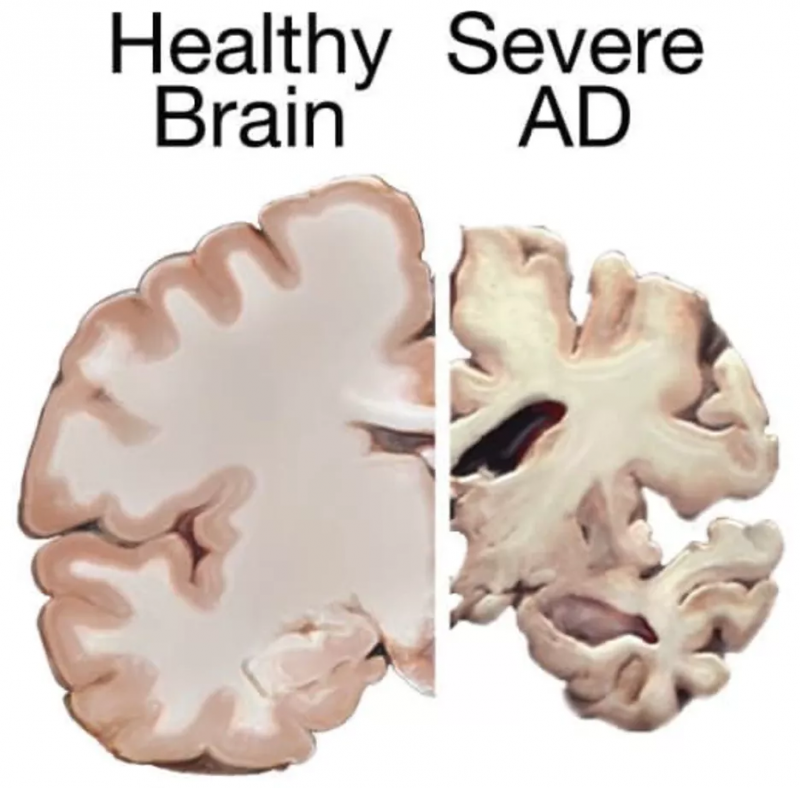
健康大腦與重癥阿爾茨海默病大腦的比較。
圖片來源:美國國立衛生研究院,國家衰老研究所(侵刪)。
TREM2 的治療潛力:從實驗室發現到臨床前驗證
小膠質細胞是研究人員一直在重點研究的另一種非神經元細胞。受體蛋白的變體,比如髓樣細胞觸發性受體 2(TREM2),與阿爾茨海默病的風險增加相關(6)。2020 年 1 月,由華盛頓大學醫學院的資深研究員 Marco Colonna 領導的國際研究團隊在《Nature Medicine》雜志上發表文章,報道了一項全面的基因表達研究,對小鼠和人類大腦中與 TREM2 相關的轉錄變化進行了分析(7)。
有趣的是,通過 Chromium 單細胞基因表達開展的單核測序表明,小鼠模型和人類大腦中的 AD 病癥所表達的轉錄特征大相徑庭。AD 小鼠模型含有一個獨特的活化小膠質細胞群體,稱為疾病相關的小膠質細胞(DAM),其存在依賴于 Aβ 和 TREM2。相比之下,人類 AD 樣本中的小膠質細胞群體,其轉錄特征與外周神經損傷中觀察到的相似。不過,這還不是 TREM2 故事的 zuì 終結局。這項研究還發現,表達 TREM2 的 R47H 和 R62H 變體的患者在小膠質細胞的激活上存在缺陷,這表明 TREM2 仍在人類 AD 發病機理中起到重要作用。
這些發現以及其他一些有希望的基礎研究,提出 TREM2 有可能成為良好的治療靶點。為了檢驗這種可能性,Colonna 實驗室的成員與專注于神經退行性疾病的制藥公司 Alector LLC 合作,對 AL002c(一種抗人 TREM2 的激動型單克隆抗體)是否能夠調節小膠質細胞激活以及 AD 進行臨床前驗證(8)。在確認 AL002c 能夠激活 hTREM2 后,他們采用 Chromium 單細胞基因表達技術來鑒定這種治療劑的急性給藥如何影響小膠質細胞的激活。
根據基因表達譜,他們將小膠質細胞(n = 31,948)細分為穩態小膠質細胞、1 期 DAM、過渡性小膠質細胞、增殖性小膠質細胞,以及表達 IFN 誘導基因的小膠質細胞。AL002c 的小鼠急性給藥讓具有穩態轉錄圖譜的小膠質細胞數量下降,并讓過渡性和增殖性小膠質細胞的數量增加,而這兩種都是之前未發現的新亞型。在含有 TREM2 變體的轉基因小鼠中也觀察到這種誘導的增殖。
進一步的實驗表明,持續的 AL002c 治療在總體上產生了積極的結果,包括絲狀 Aβ 斑塊和神經突損害減少,受影響的行為減少,以及小膠質細胞炎癥反應減輕。這些臨床前評估以及人體初次 I 期臨床試驗的安全性結果表明,AL002c 作為一種有希望的 AD 治療候選藥物,值得進一步研究。
加深我們對 AD 的認識
盡管科學家還在努力揭示阿爾茨海默病的分子基礎,但這些研究表明,有了單細胞 RNA-seq 等強大工具,他們如今有能力應對疾病的生物學復雜性。隨著與疾病相關的細胞亞群的遺傳和功能差異得到更好的鑒定,科學家能夠解決之前無法回答的問題,清除影響我們全面認識 AD 的障礙。之后,他們可使用這些基本發現去評估新的、更有希望的藥物靶點的臨床前可行性。
本文來源:10x Genomics(侵刪)
參考資料:
https://www.alz.org/alzheimers-dementia/facts-figures
https://www.advisory.com/daily-briefing/2020/02/12/alzheimers-disease
https://www.npr.org/sections/health-shots/2020/06/25/883026917/alzheimer-s-research-is-going-back-to-basics-to-find-best-way-forward
BD Strooper, E Karran. The Cellular Phase of Alzheimer’s Disease. Cell. 164, 603–615 (2016).
N Habib et al., Disease-Associated Astrocytes in Alzheimer’s Disease and Aging. Nat. Neurosci. 23, 701–706 (2020).
T K Ulland, M Colonna. TREM2 — A Key Player in Microglial Biology and Alzheimer Disease. Nat. Rev. Neurol. 14, 667–675 (2018).
Y Zhou et al., Human and Mouse Single-Nucleus Transcriptomics Reveal TREM2-Dependent and TREM2-Independent Cellular Responses in Alzheimer’s Disease. Nat. Med. 26, 131–142 (2020).
S Wang et al., Anti-Human TREM2 Induces Microglia Proliferation and Reduces Pathology in an Alzheimer’s Disease Model. J. Exp. Med. 217, e20200785 (2020).
更多伯豪生物人工服務:


