技術(shù)背景
2018 年以來,越來越多的藥物研發(fā)機構(gòu)開始注意到單細胞測序技術(shù)在藥物研發(fā)上的優(yōu)勢。首先是通過分析不同病人樣本的單細胞圖譜來挖掘潛在的靶點(細胞、通路和分子),主要是在 RNA 和蛋白水平上篩選及驗證細胞特異性表達的藥物靶標。其次,探究病人組織微環(huán)境中細胞類型與分子特征的相關(guān)性,如靶標與特定的免疫細胞或基質(zhì)細胞、信號通路、空間位置、受體配體等的相關(guān)性,從而更好地確定靶標的作用方式及細胞 - 細胞相互作用。一旦確定了靶點,需將候選模型與病人的單細胞表達譜進行比較,以確定匹配的模型。并且單細胞測序還能用于進一步探究細胞構(gòu)成及基因表達在用藥前后的變化,及治療有效 / 無效之間的差異,以評估治療過程及新藥物的有效性;此外,對不同藥物及其組合進行單細胞測序比較,還可篩選治療組合。

為什么 更多科研工作者 選擇 伯豪生物單細胞測序技術(shù)服務(wù)?
2020 年,行業(yè)首份《單細胞測序行研報告》系伯豪生物編寫、聯(lián)合出版;
2021 年,Bio-protocol 單細胞測序技術(shù)實驗方法復(fù)現(xiàn)集系伯豪生物聯(lián)合出版;
●大樣本量驗證:30 萬樣本 / 年,伯豪專業(yè)技術(shù)服務(wù)團隊實驗經(jīng)驗豐富;
●嚴格質(zhì)量標準:QA 系統(tǒng)為您實驗全程護航,實驗嚴格按照 156 個 SOP 文件進行;
●實驗記錄完備: 嚴格的流水線作業(yè)項目管理流程,保證所有實驗記錄可供回溯;
●多重實驗質(zhì)控: 實驗室 QC、數(shù)據(jù)分析 QC、項目管理 QC,3 重 QC 有效減少低質(zhì)量數(shù)據(jù)。
伯豪生物 單細胞測序技術(shù) 能夠應(yīng)用到哪些領(lǐng)域?
單細胞測序技術(shù)以其高通量、高分辨率的特點,使人們開始意識到它在藥物研發(fā)中的巨大潛力,包括在單細胞水平上進行高通量地藥物靶點篩選、藥代動力學(xué)分析、藥效評價等,極大地縮減藥物發(fā)現(xiàn)周期、節(jié)約新藥研發(fā)成本。單細胞測序技術(shù)為新藥研發(fā)注入新的希望,有助于藥物研發(fā)機構(gòu)優(yōu)化新藥研發(fā)管線。
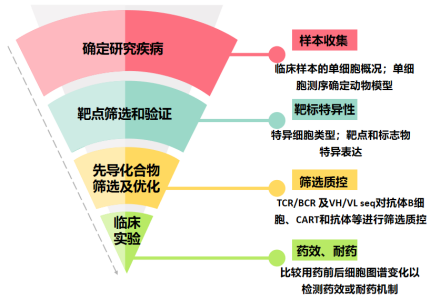
▲驅(qū)動藥物開發(fā)的單細胞測序技術(shù)

案例 1:
2018 高級別漿液性卵巢癌(high-grade serous ovarian carcinoma)是致死率高的婦科惡性腫瘤。目前對漿液性卵巢癌的治療方案創(chuàng)新極其受限,主要原因之一就是缺乏一個穩(wěn)定的腫瘤分子分型體系。2020 年 2 月 10 日,牛津大學(xué) Weatherall 分子醫(yī)學(xué)研究所 Ahmed A. Ahmed 實驗室和曼徹斯特大學(xué) Christopher Yau 研究組在 Cancer Cell(IF=26.6)雜志發(fā)表相關(guān)研究論文 [1]。這項研究通過深度單細胞 RNA 測序技術(shù) Smart-Seq2 刻畫了人輸卵管上皮組織,共測序了約 6000 個主要來自非卵巢癌病人的正常輸卵管上皮細胞(非癌細胞),發(fā)現(xiàn)并驗證了輸卵管上皮內(nèi)的 6 種新細胞亞型,包括 4 種分泌細胞亞型,1 種分泌 - 纖毛中間態(tài)細胞亞型以及 1 種特殊的組織原位 T 細胞。非癌癥病人和癌癥病人的輸卵管上皮細胞都有 Cellcycle, EMT, Differentiated 和 KRT17 cluster 四個亞群的細胞。通過分析發(fā)現(xiàn) TCGA 和 AOCS 數(shù)據(jù)庫很大比例的樣本都可以通過 52 個 marker 基因(7 differentiated markers, 10 KRT17 cluster markers, 12 EMT markers, 15 cell-cycle markers, 和 8 ciliated markers)形成的 panel 進行主要分群。研究者們進一步發(fā)現(xiàn)“分解”分析(deconvolution)中的 EMT(epithelial-mesenchymal transition,上皮 - 間質(zhì)轉(zhuǎn)化)細胞狀態(tài)的比例和病人預(yù)后顯著負相關(guān),12 個 EMT marker 顯示表達比例越高的病人其生存期越低,且這一相關(guān)性在九個獨立數(shù)據(jù)庫中都可被重復(fù)出來。為了進一步證明 EMT 及其他四種細胞狀態(tài)的信號可來自于癌細胞,研究者們利用激光捕獲顯微切割技術(shù)(LCM)獲取了純度更高的腫瘤樣本,并進行了轉(zhuǎn)錄組測序,對 LCM 樣本數(shù)據(jù)分析重現(xiàn)了在 TCGA 等公共數(shù)據(jù)庫里的發(fā)現(xiàn),并通過免疫熒光染色在組織切片和卵巢癌細胞系 KURAMOCHI 中進行了驗證。總之,這項研究利用單細胞測序定義了一個腫瘤分子分型體系,對卵巢癌的預(yù)后分析帶來重要影響。
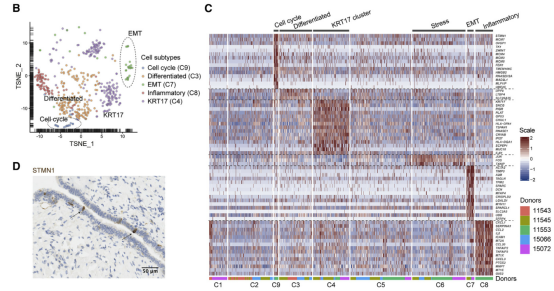
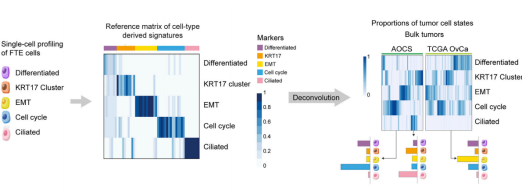
案例 2:
CD73 是一個抗腫瘤的熱門靶點。免疫檢查點療法(ICT),例如抗 CTLA- 4 和抗 PD-1/PD-L1 已經(jīng)極大地變革了人們對多種腫瘤的治療方式。但是臨床上只對部分特定腫瘤類型的患者提供持久的抗腫瘤反應(yīng)。腫瘤特異性免疫檢查點靶向的機制基礎(chǔ)尚不清楚。為了深入了解腫瘤特異性免疫調(diào)節(jié)靶點,來自美國德克薩斯大學(xué) MD 安德森癌癥中心 Padmanee Sharma 研究團隊通過分析多種病人來源的 5 種不同類型腫瘤中浸潤的免疫細胞分型,發(fā)現(xiàn)了神經(jīng)膠質(zhì)瘤中特異性存在 CD73(hi) 的巨噬細胞。研究團隊對四個 GBM 腫瘤進行了單細胞 RNA 測序 [3],細胞分成了 17 個亞群,包含了 4 個 CD3+ T 細胞和 10 個 CD3?CD68+ 髓系細胞。在 10 個 CD3?CD68+ 髓系細胞中,其中有 4 個是 CD73(hi)。ScRNA-seq 顯示 CD73(hi) 髓樣細胞富含免疫抑制基因,并且具有與常駐小膠質(zhì)細胞特征不同的特征。將 CD73 巨噬細胞的基因與癌癥基因組圖譜(TCGA) 中的膠質(zhì)母細胞瘤樣本進行比較,結(jié)果表明 CD73 高表達的巨噬細胞的基因特征與存活率下降相關(guān)。研究人員分析了 5 名接受過 PD- 1 抑制劑 Keytruda 治療和 7 名未接受過 PD- 1 抑制劑治療的膠質(zhì)母細胞瘤患者,均發(fā)現(xiàn)了表達 CD73 的巨噬細胞簇,說明抗 PD- 1 治療沒有使膠質(zhì)母細胞瘤的微環(huán)境發(fā)生明顯改變。
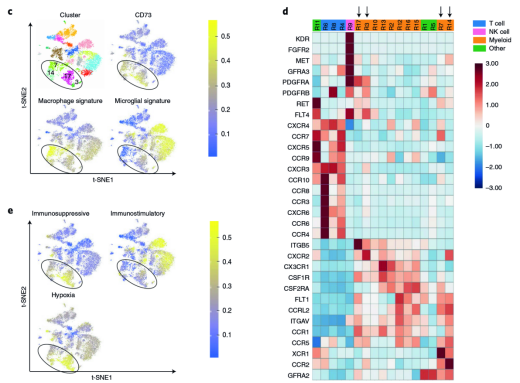
▲圖 CD73(hi) 巨噬細胞特異性存在于 GBM 中 [2]
為驗證 CD73 是否可以在 GBM 治療中作為一種聯(lián)合治療的靶點。研究人員在 WT 和 CD73-/- 小鼠中構(gòu)建 GL261 GBM 腫瘤模型,CD73 的缺失可以通過調(diào)控腫瘤內(nèi)髓系細胞的亞群改變而提高小鼠生存。同時,CD73 的缺失可以提高 GBM 小鼠模型對抗 PD- 1 和抗 CTLA- 4 聯(lián)合治療的響應(yīng),提高了 iNOS+ 免疫刺激巨噬細胞和顆粒酶素 B + CD8 T 細胞在瘤內(nèi)比例。腫瘤微環(huán)境中存在多種免疫檢查點,本研究通過對多種不同類型腫瘤細胞浸潤免疫細胞分析,發(fā)現(xiàn)不同免疫檢查點的存在是有腫瘤類型特異性的,其中 CD73hi 髓系細胞亞群,特異性出現(xiàn)在 GBM 中,靶向 CD73 分子可提高機體對免疫檢查點療法的響應(yīng)和療效。
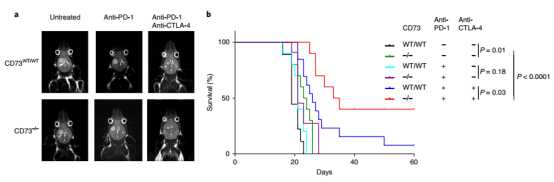
▲圖 在 GBM 小鼠模型中,CD73 的缺失增強了 ICT 的療效 [2]
引用文獻:
[1]. Hu Z, Artibani M, Alsaadi A, et al. The Repertoire of Serous Ovarian Cancer Non-genetic Heterogeneity Revealed by Single-Cell Sequencing of Normal Fallopian Tube Epithelial Cells[J]. Cancer Cell, 2020, 37(2):226-242.
[2]. Goswami S, Walle T, Cornish A E, et al. Immune profiling of human tumors identifies CD73 as a combinatorial target in glioblastoma[J]. Nature Medicine, 2020, 26(1):1-8.
案例 1:抗體藥 PD1/PDL1
腫瘤浸潤性淋巴細胞(tumor infiltrating lymphocytes, TIL):浸潤在腫瘤內(nèi)的淋巴細胞,以 T 細胞為主,也含有其他免疫細胞。由于里邊含有能夠識別殺傷腫瘤的 T 細胞(腫瘤反應(yīng)性 T 細胞,tumor reactive T cells)而備受關(guān)注。阻斷 T 細胞抑制性檢查點受體的免疫療法已經(jīng)改變了癌癥患者的臨床護理。然而 T 細胞對檢查點阻斷的反應(yīng)是否依賴于預(yù)先存在的腫瘤浸潤淋巴細胞的再激活或新 T 細胞的募集尚不清楚。2019 年一項發(fā)表于 Nature Medicine 上的研究從 11 位診斷為基底細胞癌患者接受 PD- 1 抑制劑治療前后的組織標本中獲取 T 細胞進行 RNA 單細胞測序和 TCR 測序,以研究 PD- 1 抑制劑是否通過腫瘤浸潤 T 細胞的“再激活”或是通過招募新的 T 細胞到達腫瘤區(qū)域發(fā)揮抗腫瘤效應(yīng) [3]。
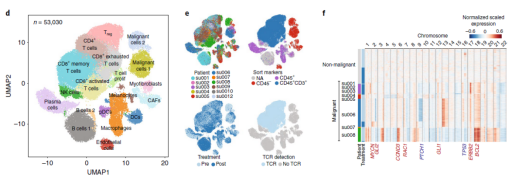
▲圖 11 例患者治療前后所有腫瘤細胞聚類 [3]
本研究的重點是免疫細胞,尤其是浸潤性免疫細胞,以及治療前后的變化,以了解克隆性 T 細胞對 PD- 1 抗體治療的反應(yīng)。因此研究人員把所有的 33106 個腫瘤浸潤性 T 細胞做了個更細致的分類,包括表達 CD4 的調(diào)節(jié)性 T 細胞(Treg)細胞,濾泡輔助性 T(TFH)細胞,T 輔助細胞 17(TH17)細胞;以及表達 CD8 的幼稚細胞,記憶 T 細胞,效應(yīng)記憶 T 細胞,活化 T 細胞,慢性活化 / 耗竭 T 細胞,中度耗竭 / 活化細胞。進一步分析發(fā)現(xiàn),在 PD- 1 抗體治療之后,濾泡輔助性 T 細胞,以及活化,耗竭和耗竭 / 活化的 CD8 陽性 T 細胞的頻率增加,并且耗竭 T 細胞的克隆水平明顯更高。更為讓研究人員感到意外的是,對于同一個患者而言,治療后記憶 T 細胞和效應(yīng) T 細胞頻繁轉(zhuǎn)換為活化狀態(tài),但是治療前的耗竭 T 細胞卻沒有變成治療后的非耗竭表型。這表明,即使在 PD- 1 抗體治療后,已經(jīng)耗竭的腫瘤浸潤 T 細胞也很難再變成活化狀態(tài)。此外,研究人員還觀察到一個有趣的現(xiàn)象,PD- 1 抗體治療后才出現(xiàn)的耗竭性 T 細胞表現(xiàn)出了新的 TCR 特異性。為了分析外周血中是否存在新發(fā)現(xiàn)的腫瘤浸潤性 T 細胞,研究人員給患者的血液樣品做了 TCR 測序,發(fā)現(xiàn) 35.5% 新腫瘤浸潤性 T 細胞可以在 PD- 1 抗體治療后的外周血中找到,而在治療前的外周血中只能找到 11.8% 的新腫瘤浸潤性 T 細胞,不過治療前的腫瘤里面卻沒有新腫瘤浸潤性 T 細胞。總的來說,與“冷”腫瘤相比,“熱”腫瘤之所以響應(yīng) PD- 1 抗體的治療,可能是由于“熱”腫瘤自身的特性,讓它能夠不斷吸引新 T 細胞進入,而不是重新激活已有的腫瘤浸潤性 T 細胞。這項研究讓我們對免疫檢查點抑制劑的作用機制有了新的認知,這對臨床治療和療效的檢測都有一定的價值和意義。
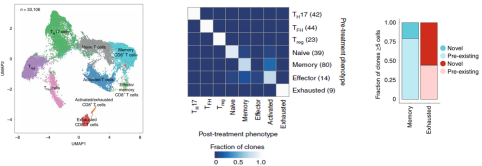
案例 2:細胞治療
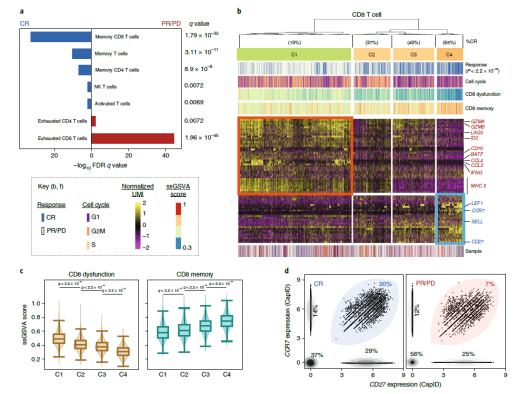
目前,以 CD19 為靶點的 CAR- T 細胞治療已被證明對復(fù)發(fā)性、難治性 B 細胞惡性腫瘤如 B 細胞非霍奇金淋巴瘤(NHL)、急性淋巴細胞白血病(ALL)和慢性淋巴細胞白血病(CLL)有顯著的治療作用 [4]。雖然抗 CD19 CAR- T 細胞治療的早期結(jié)果令人欣喜,但是只有不到一半的患者出現(xiàn)了長期的緩解,這意味著大多數(shù)患者在接受治療后要么沒有反應(yīng)要么出現(xiàn)了復(fù)發(fā)。CAR- T 細胞治療在不同患者中出現(xiàn)的這些差異的原因到底是什么?2020 年 10 月 5 日在線發(fā)表在《Nature Medicine》雜志上的文章探討了這一問題。對 24 例大 B 細胞淋巴瘤(LBCL) 患者輸注自體 CAR- T 細胞后,研究人員對 137,326 個殘留的細胞進行了全轉(zhuǎn)錄組 scRNA-seq[5]。
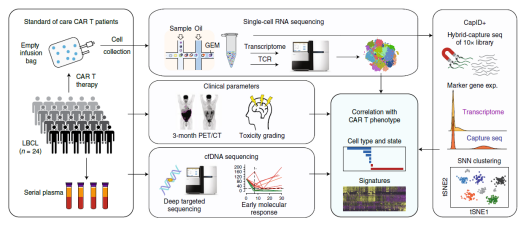
▲圖 工作流程圖 [5]
比較全部恢復(fù)(CR) 患者和疾病進行 / 部分恢復(fù)(PR/PD) 患者輸注產(chǎn)物的細胞類型和功能狀態(tài),研究人員發(fā)現(xiàn) PR/PD 患者的輸注產(chǎn)物中衰竭的 CD8 和 CD4 T 細胞顯著富集,而 CR 患者的輸注產(chǎn)物中記憶 CD8 T 細胞顯著富集。CR 患者和 PR/PD 患者 CD8 T 細胞的差異表達基因(DEG)鑒定出 4 類細胞群,這些差異表達基因大多與 CD8 T 細胞的激活和衰竭有關(guān),雖然每個細胞群都包含來自所有患者的細胞,但是來自 CR 患者的細胞的相對比例在各個細胞群之間存在顯著差異。CD4 T 細胞的 DEG 分析和聚類也表現(xiàn)出類似結(jié)果,不同的是增殖相關(guān)基因和周期細胞在 CR 患者的高頻細胞聚類中表達較高。由此強調(diào)了與臨床療效相關(guān)的 CAR- T 細胞輸注產(chǎn)物細胞的重要轉(zhuǎn)錄特征。研究表明輸注的 CAR T 細胞產(chǎn)物的細胞和分子多樣性是導(dǎo)致經(jīng)抗 CD19-CAR- T 細胞治療的 LBCL 患者療效和毒性差異的主要因素,與輸注產(chǎn)物相關(guān)的可量化表型可通過在其產(chǎn)生過程中富集所需的、或消除不期望的細胞群體或功能狀態(tài)而發(fā)揮作用。對離散細胞群導(dǎo)致反應(yīng)不良或高毒性的機制的了解,可能有助于發(fā)現(xiàn)治療干預(yù)的途徑,從而提高療效,降低 CAR- T 細胞輸注后的毒性。
引用文獻
[3]. Li X, Wang M, Xiang R. Clonal replacement of novel T cells: a new phenomenon in the tumor microenvironment following PD-1 blockade[J]. Signal Transduction and Targeted Therapy, 2019, 4:43.
[4] Neelapu Sattva S, Locke Frederick L, Bartlett Nancy L, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma[J]. New England Journal of Medicine, 2017, 377:2531-2544.
[5] Deng Qing, Han Guangchun, Puebla-Osorio Nahum, et al. Characteristics of anti-CD19 CAR T cell infusion products associated with efficacy and toxicity in patients with large B cell lymphomas[J]. Nature Medicine, 2020, 26:1878-1887.
案例 1:病毒疫苗
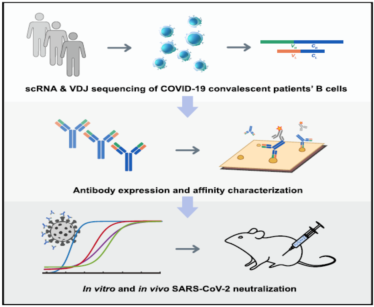
謝曉亮教授團隊利用高通量單細胞 RNA 和 VDJ 測序平臺,從 60 位康復(fù)期病人身上篩選出 8558 種病毒蛋白結(jié)合抗體序列,成功找出 14 株高活性的中和抗體。其中編號為 BD-368- 2 的抗體表現(xiàn)突出,在假病毒實驗中的半抑制濃度(IC50)達到 1.2 ng/mL(8pM);在軍事醫(yī)學(xué)研究院 P3 實驗室進行的真病毒實驗中,IC50 達到 15 ng/mL(100pM)。中和抗體體內(nèi)抗病毒實驗進一步證實,利用 hACE2 轉(zhuǎn)基因小鼠模型,感染 SARS-Cov- 2 后給予 BD-368- 2 的治療使病毒載量下降~2400 倍。而注射 BD-368- 2 后可完全抑制小鼠的病毒感染,達到預(yù)防效果。研究團隊還利用冷凍電鏡得到新冠病毒 Spike 三聚體與中和抗體的高分辨率 3.8?三維結(jié)構(gòu)密度圖。數(shù)據(jù)顯示,抗原上的中和抗體表位與 ACE2 的結(jié)合位點重合,從而揭示出中和作用的結(jié)構(gòu)基礎(chǔ)。此外,研究人員還證明了可以根據(jù) CDR3H 結(jié)構(gòu)的相似性來選擇 SARS-CoV- 2 中和抗體 [7]。
案例 2:病毒疫苗
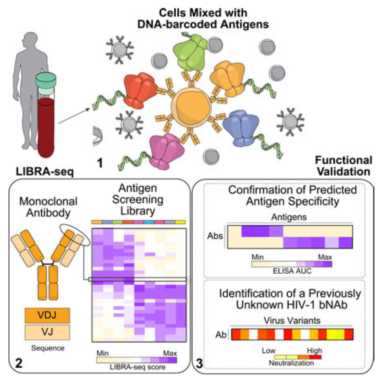
范德比爾特大學(xué)的研究組在 Cell 雜志上發(fā)表文章 [8],提出了一種名為 LIBRA-seq 的新的測序技術(shù)。作者構(gòu)建了一個特殊的抗原庫,將抗原連接上 DNA 條碼和用于流式細胞術(shù)分選的熒光標簽。接下來,將這個庫與富含 B 細胞的樣本共孵育。將連有熒光標簽的抗原和與之結(jié)合的 B 細胞共同分選出來,并進行測序,從而得到 BCR- 抗原序列圖譜。利用 LIBRA-seq,研究人員繪制了來自兩名 HIV 感染者的數(shù)千個 B 細胞的抗原特異性圖譜,許多 HIV 和流感特異性抗體的預(yù)測特異性得到證實。這項技術(shù)可以有效地繪制 BCR 序列及其對應(yīng)的特異性抗原圖譜,在抗體研發(fā)和疫苗制備領(lǐng)域具有廣泛的應(yīng)用。
案例 3:個性化腫瘤疫苗
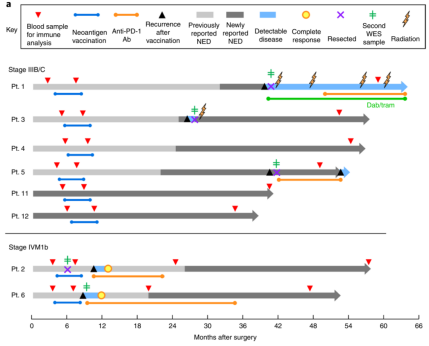
NeoVax 是一種新抗原(Neoantigen)腫瘤疫苗,主要以新抗原為靶點。新抗原通常是腫瘤細胞在發(fā)生發(fā)展過程中,隨機突變產(chǎn)生的新的蛋白質(zhì)或多肽,一般特異性表達于腫瘤細胞中但不存在與正常組織細胞中。因此,新抗原也成為了腫瘤免疫治療的理想靶點。早在 2017 年,美國 Dana Farber 癌癥研究所應(yīng)用 NeoVax 治療惡性黑色素瘤患者,并取得的良好療效。6 名高復(fù)發(fā)風(fēng)險的患者在術(shù)后 18 周開始接受 NeoVax 疫苗治療。在接種后的 2 年多時間內(nèi),4 名患者未發(fā)現(xiàn)腫瘤復(fù)發(fā);另外 2 名惡性黑色素瘤伴肺轉(zhuǎn)移的患者,在接種疫苗后復(fù)發(fā),隨即開始接受 PD-1 單抗藥物的治療,也獲得完全緩解并處于無疾病進展狀態(tài) [9]。為了進一步探究 NeoVax 腫瘤疫苗的遠期臨床療效及其機制,研究人員對上述 6 名患者及新入組的 2 名患者進行長期隨訪。在術(shù)后 4 年多(55 個月)的中位數(shù)隨訪中,8 名患者全部存活,其中 3 名患者仍未出現(xiàn)復(fù)發(fā)。復(fù)發(fā)的 5 名患者中,2 名 IV 期患者接受 pembrolizumab(PD- 1 單抗)治療后完全緩解(2017 年已報道),1 名患者接受了手術(shù)切除且仍未發(fā)現(xiàn)疾病證據(jù)(NED),2 名患者發(fā)展為不可切除的轉(zhuǎn)移性疾病。
對于如此令人興奮的長期臨床療效,研究人員期望揭示患者體內(nèi)的變化和機制。研究人員首先試圖確定 NeoVax 疫苗誘導(dǎo)的特異性 T、細胞在外周血中的功能狀態(tài)是如何演變的。他們對新抗原特異性 T 細胞,尤其是 CD4+ T 細胞的特征進行了跟蹤和分析。結(jié)果發(fā)現(xiàn),NeoVax 疫苗誘導(dǎo)的新抗原特異性 CD4+ T 細胞表現(xiàn)出記憶性和細胞毒性特征。進一步分析了這些患者的 T 細胞,發(fā)現(xiàn)這些患者體內(nèi)不僅產(chǎn)生了靶向的目標新抗原的特異性 T 細胞,而且還擴展到識別其他與黑色素瘤相關(guān)的新抗原,起到了更強更持久的抗腫瘤效果 [10]。

引用文獻:
[7]. Yunlong Cao, Bin Su, Xianghua Guo, et al. Potent Neutralizing Antibodies against SARS-CoV-2 Identified by High-Throughput Single-Cell Sequencing of Convalescent Patients’B Cells[J]. Cell, 2020, 182(1):73-84.
[8]. Setliff I, Shiakolas A R, Pilewski K A, et al. High-Throughput Mapping of B Cell Receptor Sequences to Antigen Specificity[J]. Cell, 2019, 179(7):1636-1646.
[9]. Ott PA, Hu Z, Keskin DB, et al. An immunogenic personal neoantigen vaccine for patients with melanoma[J]. Nature, 2017, 547(7662):217-221.
[10]. Zhuting Hu, Donna E Leet, Rosa L Alles?e, et al. Personal neoantigen vaccines induce persistent memory T cell responses and epitope spreading in patients with melanoma[J]. Nature Medicine, 2021, 27(3):515-525.
案例 1:病毒疫苗
謝曉亮教授團隊利用高通量單細胞 RNA 和 VDJ 測序平臺,從 60 位康復(fù)期病人身上篩選出 8558 種病毒蛋白結(jié)合抗體序列,成功找出 14 株高活性的中和抗體。其中編號為 BD-368- 2 的抗體表現(xiàn)突出,在假病毒實驗中的半抑制濃度(IC50)達到 1.2 ng/mL(8pM);在軍事醫(yī)學(xué)研究院 P3 實驗室進行的真病毒實驗中,IC50 達到 15 ng/mL(100pM)。中和抗體體內(nèi)抗病毒實驗進一步證實,利用 hACE2 轉(zhuǎn)基因小鼠模型,感染 SARS-Cov- 2 后給予 BD-368- 2 的治療使病毒載量下降~2400 倍。而注射 BD-368- 2 后可完全抑制小鼠的病毒感染,達到預(yù)防效果。研究團隊還利用冷凍電鏡得到新冠病毒 Spike 三聚體與中和抗體的高分辨率 3.8?三維結(jié)構(gòu)密度圖。數(shù)據(jù)顯示,抗原上的中和抗體表位與 ACE2 的結(jié)合位點重合,從而揭示出中和作用的結(jié)構(gòu)基礎(chǔ)。此外,研究人員還證明了可以根據(jù) CDR3H 結(jié)構(gòu)的相似性來選擇 SARS-CoV- 2 中和抗體 [7]。

案例 2:病毒疫苗
范德比爾特大學(xué)的研究組在 Cell 雜志上發(fā)表文章 [8],提出了一種名為 LIBRA-seq 的新的測序技術(shù)。作者構(gòu)建了一個特殊的抗原庫,將抗原連接上 DNA 條碼和用于流式細胞術(shù)分選的熒光標簽。接下來,將這個庫與富含 B 細胞的樣本共孵育。將連有熒光標簽的抗原和與之結(jié)合的 B 細胞共同分選出來,并進行測序,從而得到 BCR- 抗原序列圖譜。利用 LIBRA-seq,研究人員繪制了來自兩名 HIV 感染者的數(shù)千個 B 細胞的抗原特異性圖譜,許多 HIV 和流感特異性抗體的預(yù)測特異性得到證實。這項技術(shù)可以有效地繪制 BCR 序列及其對應(yīng)的特異性抗原圖譜,在抗體研發(fā)和疫苗制備領(lǐng)域具有廣泛的應(yīng)用。

案例 3:個性化腫瘤疫苗
NeoVax 是一種新抗原(Neoantigen)腫瘤疫苗,主要以新抗原為靶點。新抗原通常是腫瘤細胞在發(fā)生發(fā)展過程中,隨機突變產(chǎn)生的新的蛋白質(zhì)或多肽,一般特異性表達于腫瘤細胞中但不存在與正常組織細胞中。因此,新抗原也成為了腫瘤免疫治療的理想靶點。早在 2017 年,美國 Dana Farber 癌癥研究所應(yīng)用 NeoVax 治療惡性黑色素瘤患者,并取得的良好療效。6 名高復(fù)發(fā)風(fēng)險的患者在術(shù)后 18 周開始接受 NeoVax 疫苗治療。在接種后的 2 年多時間內(nèi),4 名患者未發(fā)現(xiàn)腫瘤復(fù)發(fā);另外 2 名惡性黑色素瘤伴肺轉(zhuǎn)移的患者,在接種疫苗后復(fù)發(fā),隨即開始接受 PD-1 單抗藥物的治療,也獲得完全緩解并處于無疾病進展狀態(tài) [9]。為了進一步探究 NeoVax 腫瘤疫苗的遠期臨床療效及其機制,研究人員對上述 6 名患者及新入組的 2 名患者進行長期隨訪。在術(shù)后 4 年多(55 個月)的中位數(shù)隨訪中,8 名患者全部存活,其中 3 名患者仍未出現(xiàn)復(fù)發(fā)。復(fù)發(fā)的 5 名患者中,2 名 IV 期患者接受 pembrolizumab(PD- 1 單抗)治療后完全緩解(2017 年已報道),1 名患者接受了手術(shù)切除且仍未發(fā)現(xiàn)疾病證據(jù)(NED),2 名患者發(fā)展為不可切除的轉(zhuǎn)移性疾病。

對于如此令人興奮的長期臨床療效,研究人員期望揭示患者體內(nèi)的變化和機制。研究人員首先試圖確定 NeoVax 疫苗誘導(dǎo)的特異性 T、細胞在外周血中的功能狀態(tài)是如何演變的。他們對新抗原特異性 T 細胞,尤其是 CD4+ T 細胞的特征進行了跟蹤和分析。結(jié)果發(fā)現(xiàn),NeoVax 疫苗誘導(dǎo)的新抗原特異性 CD4+ T 細胞表現(xiàn)出記憶性和細胞毒性特征。進一步分析了這些患者的 T 細胞,發(fā)現(xiàn)這些患者體內(nèi)不僅產(chǎn)生了靶向的目標新抗原的特異性 T 細胞,而且還擴展到識別其他與黑色素瘤相關(guān)的新抗原,起到了更強更持久的抗腫瘤效果 [10]。

引用文獻:
[7]. Yunlong Cao, Bin Su, Xianghua Guo, et al. Potent Neutralizing Antibodies against SARS-CoV-2 Identified by High-Throughput Single-Cell Sequencing of Convalescent Patients’B Cells[J]. Cell, 2020, 182(1):73-84.
[8]. Setliff I, Shiakolas A R, Pilewski K A, et al. High-Throughput Mapping of B Cell Receptor Sequences to Antigen Specificity[J]. Cell, 2019, 179(7):1636-1646.
[9]. Ott PA, Hu Z, Keskin DB, et al. An immunogenic personal neoantigen vaccine for patients with melanoma[J]. Nature, 2017, 547(7662):217-221.
[10]. Zhuting Hu, Donna E Leet, Rosa L Alles?e, et al. Personal neoantigen vaccines induce persistent memory T cell responses and epitope spreading in patients with melanoma[J]. Nature Medicine, 2021, 27(3):515-525.

