1、抗體藥 PD1/PDL1?
腫瘤浸潤(rùn)性淋巴細(xì)胞(tumor infiltrating lymphocytes, TIL):浸潤(rùn)在腫瘤內(nèi)的淋巴細(xì)胞,以 T 細(xì)胞為主,也含有其他免疫細(xì)胞。由于里邊含有能夠識(shí)別殺傷腫瘤的 T 細(xì)胞(腫瘤反應(yīng)性 T 細(xì)胞,tumor reactive T cells)而備受關(guān)注。阻斷 T 細(xì)胞抑制性檢查點(diǎn)受體的免疫療法已經(jīng)改變了癌癥患者的臨床護(hù)理。然而 T 細(xì)胞對(duì)檢查點(diǎn)阻斷的反應(yīng)是否依賴于預(yù)先存在的腫瘤浸潤(rùn)淋巴細(xì)胞的再激活或新 T 細(xì)胞的募集尚不清楚。2019 年一項(xiàng)發(fā)表于 NatureMedicine 上的研究從 11 位診斷為基底細(xì)胞癌患者接受 PD- 1 抑制劑治療前后的組織標(biāo)本中獲取 T 細(xì)胞進(jìn)行 RNA 單細(xì)胞測(cè)序和 TCR 測(cè)序,以研究 PD- 1 抑制劑是否通過(guò)腫瘤浸潤(rùn) T 細(xì)胞的“再激活”或是通過(guò)招募新的 T 細(xì)胞到達(dá)腫瘤區(qū)域發(fā)揮抗腫瘤效應(yīng) [1]。
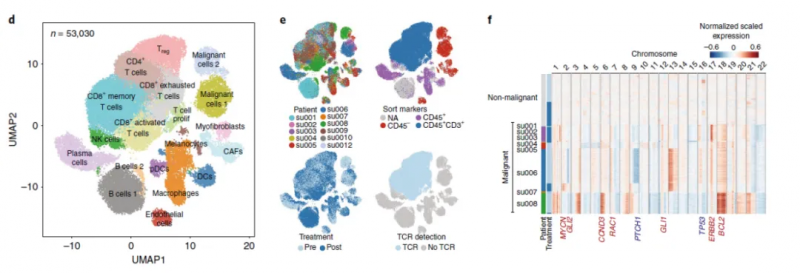
圖 ? 11 例患者治療前后所有腫瘤細(xì)胞聚類 [1]
這項(xiàng)研究的重點(diǎn)是免疫細(xì)胞,尤其是浸潤(rùn)性免疫細(xì)胞,以及治療前后的變化,以了解克隆性 T 細(xì)胞對(duì) PD- 1 抗體治療的反應(yīng)。因此研究人員把所有的 33106 個(gè)腫瘤浸潤(rùn)性 T 細(xì)胞做了個(gè)更細(xì)致的分類,包括表達(dá) CD4 的調(diào)節(jié)性 T 細(xì)胞(Treg)細(xì)胞,濾泡輔助性 T(TFH)細(xì)胞,T 輔助細(xì)胞 17(TH17)細(xì)胞;以及表達(dá) CD8 的 Naive T 細(xì)胞,記憶 T 細(xì)胞,效應(yīng)記憶 T 細(xì)胞,活化 T 細(xì)胞,慢性活化 / 耗竭 T 細(xì)胞,中度耗竭 / 活化細(xì)胞。進(jìn)一步分析發(fā)現(xiàn),在 PD- 1 抗體治療之后,濾泡輔助性 T 細(xì)胞,以及活化,耗竭和耗竭 / 活化的 CD8 陽(yáng)性 T 細(xì)胞的頻率增加,并且耗竭 T 細(xì)胞的克隆水平明顯更高。更讓研究人員感到意外的是,對(duì)于同一個(gè)患者而言,治療后記憶 T 細(xì)胞和效應(yīng) T 細(xì)胞頻繁轉(zhuǎn)換為活化狀態(tài),但是治療前的耗竭 T 細(xì)胞卻沒(méi)有變成治療后的非耗竭表型。這表明,即使在 PD- 1 抗體治療后,已經(jīng)耗竭的腫瘤浸潤(rùn) T 細(xì)胞也很難再變成活化狀態(tài)。此外,研究人員還觀察到一個(gè)有趣的現(xiàn)象,PD- 1 抗體治療后才出現(xiàn)的耗竭性 T 細(xì)胞表現(xiàn)出了新的 TCR 特異性。為了分析外周血中是否存在新發(fā)現(xiàn)的腫瘤浸潤(rùn)性 T 細(xì)胞,研究人員給患者的血液樣品做了 TCR 測(cè)序,發(fā)現(xiàn) 35.5% 新腫瘤浸潤(rùn)性 T 細(xì)胞可以在 PD- 1 抗體治療后的外周血中找到,而在治療前的外周血中只能找到 11.8% 的新腫瘤浸潤(rùn)性 T 細(xì)胞,不過(guò)治療前的腫瘤里面卻沒(méi)有新腫瘤浸潤(rùn)性 T 細(xì)胞。總的來(lái)說(shuō),與“冷”腫瘤相比,“熱”腫瘤之所以響應(yīng) PD- 1 抗體的治療,可能是由于“熱”腫瘤自身的特性,讓它能夠不斷吸引新 T 細(xì)胞進(jìn)入,而不是重新激活已有的腫瘤浸潤(rùn)性 T 細(xì)胞。這項(xiàng)研究讓我們對(duì)免疫檢查點(diǎn)抑制劑的作用機(jī)制有了新的認(rèn)知,這對(duì)臨床治療和療效的檢測(cè)都有一定的價(jià)值和意義。
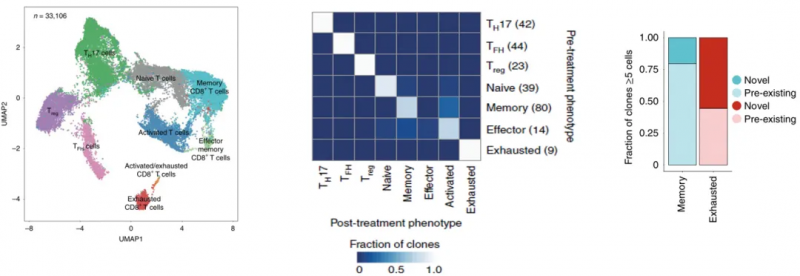
圖 腫瘤浸潤(rùn)性 T 細(xì)胞(左)、耗竭的腫瘤浸潤(rùn) T 細(xì)胞很難再變成活化狀態(tài)(中)以及治療后衰竭 CD8?+? T 細(xì)胞的克隆庫(kù)被新型克隆所取代(右)[1]
2、 細(xì)胞治療
目前,以 CD19 為靶點(diǎn)的 CAR- T 細(xì)胞治療已被證明對(duì)復(fù)發(fā)性、難治性 B 細(xì)胞惡性腫瘤如 B 細(xì)胞非霍奇金淋巴瘤(NHL)、急性淋巴細(xì)胞白血病(ALL)和慢性淋巴細(xì)胞白血病(CLL)有顯著的治療作用 [2]。雖然抗 CD19 CAR- T 細(xì)胞治療的早期結(jié)果令人欣喜,但是只有不到一半的患者出現(xiàn)了長(zhǎng)期的緩解,這意味著大多數(shù)患者在接受治療后要么沒(méi)有反應(yīng)要么出現(xiàn)了復(fù)發(fā)。CAR- T 細(xì)胞治療在不同患者中出現(xiàn)的這些差異的原因到底是什么?2020 年 10 月 5 日在線發(fā)表在《Nature Medicine》雜志上的文章探討了這一問(wèn)題。對(duì) 24 例大 B 細(xì)胞淋巴瘤(LBCL) 患者輸注自體 CAR- T 細(xì)胞后,研究人員對(duì) 137,326 個(gè)殘留的細(xì)胞進(jìn)行了全轉(zhuǎn)錄組 scRNA-seq?[3]。

圖 工作流程圖 [3]
比較全部恢復(fù)(CR) 患者和疾病進(jìn)行 / 部分恢復(fù)(PR/PD) 患者輸注產(chǎn)物的細(xì)胞類型和功能狀態(tài),研究人員發(fā)現(xiàn) PR/PD 患者的輸注產(chǎn)物中衰竭的 CD8 和 CD4 T 細(xì)胞顯著富集,而 CR 患者的輸注產(chǎn)物中記憶 CD8 T 細(xì)胞顯著富集。CR 患者和 PR/PD 患者 CD8 T 細(xì)胞的差異表達(dá)基因(DEG)鑒定出 4 類細(xì)胞群,這些差異表達(dá)基因大多與 CD8 T 細(xì)胞的激活和衰竭有關(guān),雖然每個(gè)細(xì)胞群都包含來(lái)自所有患者的細(xì)胞,但是來(lái)自 CR 患者的細(xì)胞的相對(duì)比例在各個(gè)細(xì)胞群之間存在顯著差異。CD4 T 細(xì)胞的 DEG 分析和聚類也表現(xiàn)出類似結(jié)果,不同的是增殖相關(guān)基因和周期細(xì)胞在 CR 患者的高頻細(xì)胞聚類中表達(dá)較高。由此強(qiáng)調(diào)了與臨床療效相關(guān)的 CAR- T 細(xì)胞輸注產(chǎn)物細(xì)胞的重要轉(zhuǎn)錄特征。研究表明輸注的 CAR T 細(xì)胞產(chǎn)物的細(xì)胞和分子多樣性是導(dǎo)致經(jīng)抗 CD19-CAR- T 細(xì)胞治療的 LBCL 患者療效和毒性差異的主要因素,與輸注產(chǎn)物相關(guān)的可量化表型可通過(guò)在其產(chǎn)生過(guò)程中富集所需的、或消除不期望的細(xì)胞群體或功能狀態(tài)而發(fā)揮作用。對(duì)離散細(xì)胞群導(dǎo)致反應(yīng)不良或高毒性的機(jī)制的了解,可能有助于發(fā)現(xiàn)治療干預(yù)的途徑,從而提高療效,降低 CAR- T 細(xì)胞輸注后的毒性。
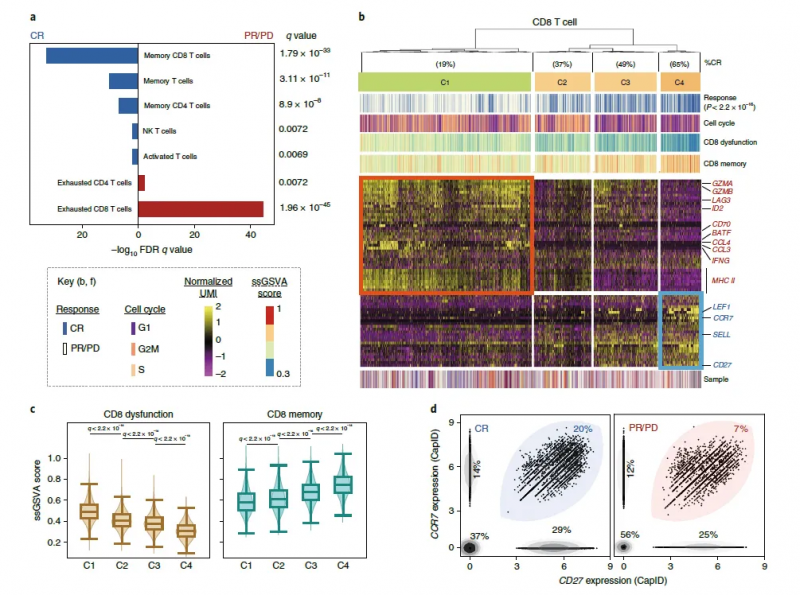
圖 CD8T 細(xì)胞細(xì)分及功能富集 [3]
參考文獻(xiàn):
[1]. Li X, Wang M, Xiang R. Clonal replacement of novel T cells: a new phenomenon in the tumor microenvironment following PD-1 blockade[J]. Signal Transduction and Targeted Therapy, 2019, 4:43.
[2]. Neelapu Sattva S, Locke Frederick L, Bartlett Nancy L, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma[J]. New England Journal of Medicine, 2017, 377:2531-2544.
[3]. Deng Qing, Han Guangchun, Puebla-Osorio Nahum, et al. Characteristics of anti-CD19 CAR T cell infusion products associated with efficacy and toxicity in patients with large B cell lymphomas[J]. Nature Medicine, 2020, 26:1878-1887.
更多伯豪生物人工服務(wù):


