文章展示
近些年,腫瘤免疫治療發展火熱,被人們寄予厚望,然而,評價一種療法除了看療效,還要看副作用。以藥物開發經常使用的指標 IC50(半抑制濃度)為例,人們更希望以很小的劑量就達到治療的效果,往往大的劑量意味著更多的副作用。那么,免疫治療是否真像看上去那么完美?2020 年 6 月 25 日哈佛大學 Kai W. Wucherpfennig 和 Michael Dougan 研究組的文章 Molecular Pathways of Colon Inflammation Induced by Cancer Immunotherapy 在 Cell 雜志上發表,研究者通過運用單細胞 RNA 測序(scRNA-seq)和流式細胞技術(flow cytometry)直接分析了近期采用免疫療法的黑色素瘤病人的腸道活體樣本,深入解析了誘發 +CPI colitis 的細胞和分子通路并預測了潛在的治療靶點。

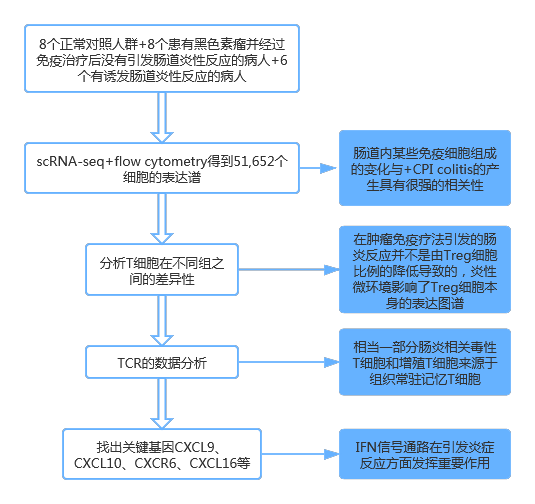
研究路線
重要結果
1. 納入免疫檢查點抑制劑(CPI)治療后發生和未發生結腸炎的患者以及健康對照,用單細胞技術分析結腸組織樣本中的免疫細胞。熱圖顯示 CD45+scRNA 序列數據集中不同亞群的差異表達基因(圖 1)。少數非免疫球蛋白可變基因對血漿 B 細胞有顯著影響。
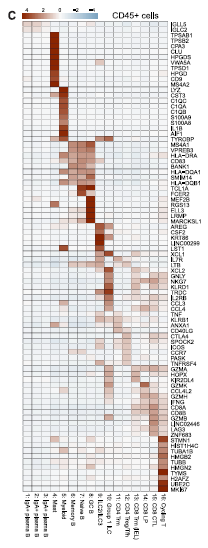
圖 1CD45+scRNA 序列數據集中不同亞群的差異表達基因
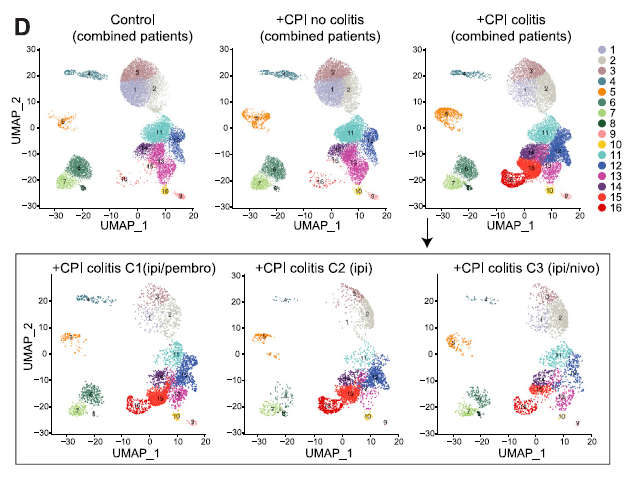
圖 2 在暴露于不同 CPI 藥物的結腸炎患者中觀察到類似的 T 細胞亞群變化,包括 ipilimumab 單藥治療(患者 C2),ipilimumab 和 nivolumab 聯合治療(患者 C3),以及序貫 pembrolizumab 和 ipilimumab(患者 C1)
2. 發生結腸炎的患者中,CD8+ 組織駐留記憶 T 細胞分化產生大量細胞毒性效應 T 細胞,可以解釋為何 CPI 能很快誘發結腸炎。CD8+ T 細胞區室的整體組織顯示 +CPI 結腸炎患者和兩個對照組之間的顯著差異:亞群 7(細胞毒性效應物)和 8(循環 T 細胞,MKI67+)幾乎不包括 +CPI 結腸炎患者(圖 3~5)。
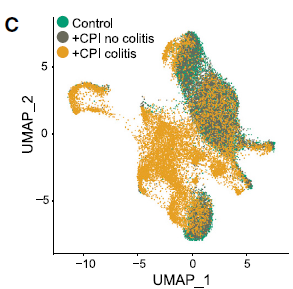
圖 3 患者組中 CD8 T 細胞亞群的分布
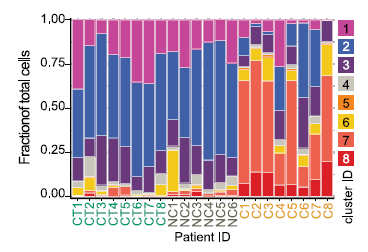
圖 4 每個患者的 8 個亞群中 CD8T 細胞的分布,CT,對照;NC,無結腸炎;C,結腸炎。
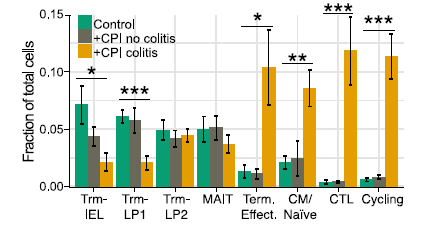
圖 5 患者組間細胞亞群頻率表征的量化
3. CTLA-4+ 調節性 T 細胞也增多并持續存在,提示結腸炎不是這些細胞缺失引起的。
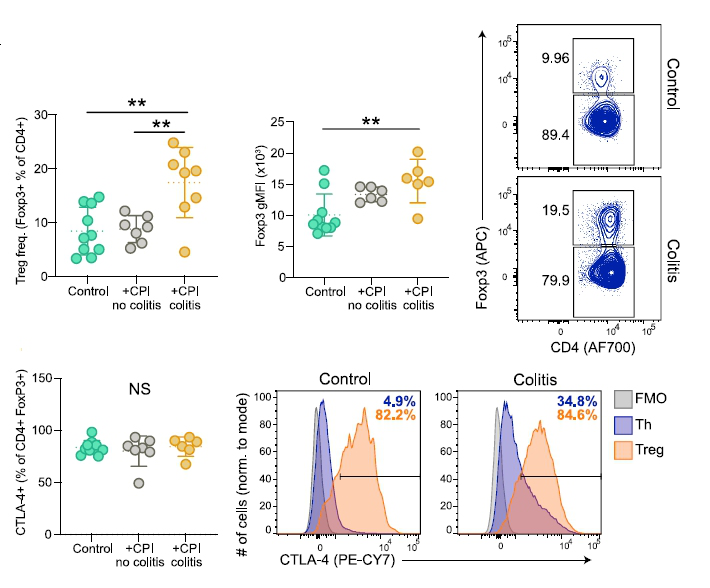
圖 6 用 FoxP3+CD4+Treg 細胞(每組 6 -10 名受試者)定量檢測 CTLA- 4 的表達
4. 鑒定出髓系細胞和 T 細胞中高表達的若干細胞因子、趨化因子和表面受體,或能作為結腸炎和其他 CPI 相關炎癥的治療靶點。
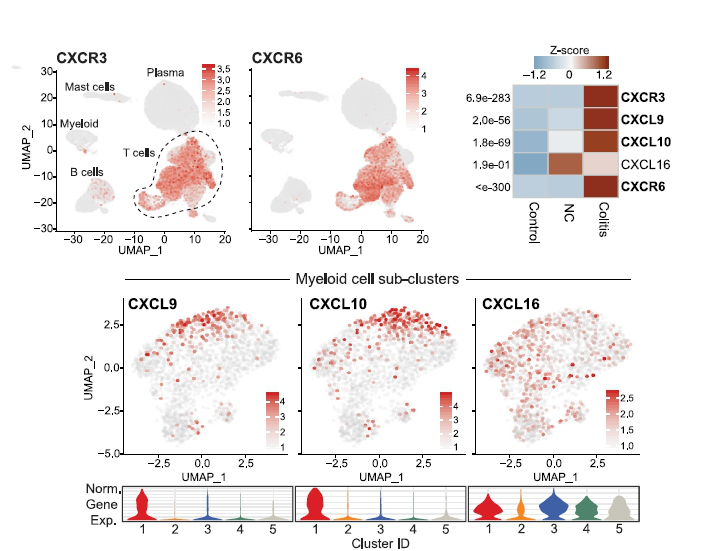
圖 7 與對照組相比,+CPI 結腸炎患者的 T 細胞中趨化因子受體基因 CXCR3 和 CXCR6 上調
小結
綜上所述,該研究初次從單細胞水平詳細探討了腸道樣本中不同免疫細胞因免疫治療引起變化的機制,發現了毒性 CD8+ T 細胞,增殖 CD8+ T 細胞以及 CD4+ Treg 細胞在 +CPI colitis 樣本中的富集,并且基于 TCR 序列信息驗證了 +CPI colitis 特異性以及 CD8+ T 細胞大部分來源于 CD8+ Trm 細胞,通過對不同細胞因子的分析識別出了潛在的因免疫檢測點阻斷誘發的腸炎或其他 irAEs 的治療靶點。
更多伯豪生物人工服務:


