之前我們略述了代謝組學的課題設計,按照設計的思路進行實驗后,就需要進行代謝樣本的收集了。今天咱按照不同類型的樣本,給大家提供一點收集的建議。
一、針對細胞類型樣本,可分為四類如下:
1、貼壁細胞
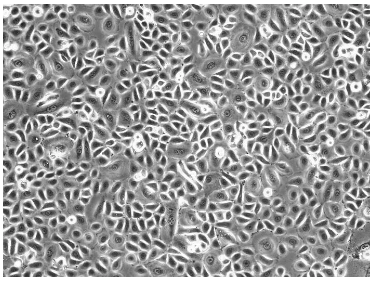
2、懸浮細胞
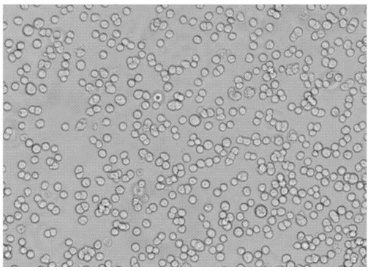
3、微生物
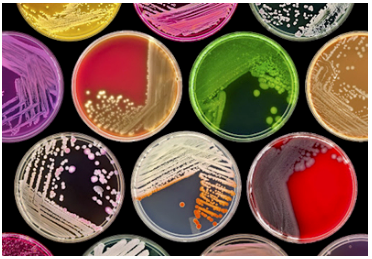
4、 胞外代謝產物

四類細胞樣本處理方法如下:
1、貼壁細胞
去除培養基,采用預冷的 PBS 清洗 2 - 3 次,離心棄去上清,加入 1ml 60% 冷甲醇,把培養容器中的所有細胞都刮取干凈,收集在 1.5ml 離心管中,液氮速凍后 -80°C 保存。

2、懸浮細胞
離心收集懸浮細胞,用預冷的 PBS 清洗 2 - 3 次,離心棄上清,收集細胞于 1.5ml 離心管中,液氮速凍后 -80°C 保存。

3、微生物
取生長對數后期的或者穩定期中段的微生物,低溫離心(4°C, 12000rpm, 10min),沉淀微生物,去掉上清液,放入液氮中或 -80°C 保存。

4、胞外代謝產物
培養基上清收集后液氮淬滅,凍干處理后 -80℃保存。

二、針對植物樣本可按部位分為根、莖葉、果實及培養液等,其樣本處理方法如下:
1、根
取植物的根部 50mg 以上,用 PBS 漂洗掉根上的泥土后用吸水紙吸掉多余水分,裝入離心管,立即用液氮速凍處理 15min,于 -80°C 下保存。

2、莖、葉、花等
參照實驗設計取特定組織部位 50mg 以上。用錫箔紙包裹并標記后,立即用液氮速凍處理 15min,于 -80°C 下保存。

3、果實
將同組的植株種子混勻后分裝 50mg 以上至凍存管中,立即用液氮速凍處理 15min,于 -80°C 下保存。(如果果實外殼較硬,需要用粉碎機打碎過篩。)

4、植物培養液
直接低溫離心(4°C, 12000rpm, 10min),取上清液,移至 1.5mL 離心管,200μL 分裝后,于 -80°C 下保存。

三、針對臨床和動物類型樣本,其樣本處理方法如下:
主要可分為體液(血清、血漿、尿液、淚液、腦脊液等)和組織類型(肝臟、腫瘤、肌肉、糞便等)等,處理方法如下:
1、血清
血液收集在不含抗凝劑的離心管中 4°C(或冰浴)靜置 1h 進行凝固分層,低溫離心(4°C, 12000rpm, 10min),取上清轉移至干凈的離心管中。取上清分裝到 1.5mL 離心管中,每管 0.2mL,于 -80°C 下保存。

2、血漿
使用肝素鈉抗凝管采集全血,輕輕搖晃采血管(避免紅細胞破裂)使抗凝劑和血液充分混合,低溫離心(4°C, 12000rpm, 10min),取上清液分裝到 1.5mL 離心管中,每管 0.2mL,于 -80°C 下保存。
3、尿液
取稱取中段尿到離心管中,低溫離心(4°C, 12000rpm, 10min),吸取澄清尿液分裝到 1.5mL 離心管中,每管 0.2mL,于 -80°C 下保存。


5、組織(肝臟、腫瘤、肌肉等)
根據實驗設計取特定組織部位,如果組織上有血液殘留,用生理鹽水將其漂洗掉,按照 100 mg/ 樣本裝入凍存管中;后立即用液氮速凍處理 15min,于 -80°C 下保存。
以上是主要常見的幾種樣本類型采集方式啦,不過生物樣本類型多樣,童鞋們有其他類型的樣本不確定如何收集可與我們直接溝通~
微信鏈接 【查看原文】
更多伯豪生物服務


